A emboloterapia ou terapia por embolização consiste na oclusão intencional de uma artéria ou veia mediante a injeção diferentes tipos produtos médicos conhecidos como agentes embólicos. Esses agentes são depositados no leito vascular através de procedimentos de cateterismo percutâneo, ou seja, pela introdução de um fino tubo plástico denominado cateter através de uma veia ou artéria da perna ou braço.
Princípios Gerais
As técnicas de Embolização surgiram como uma extensão do método angiográfico de investigação do sistema vascular. O operador deve estar capacitado para fazer um diagnóstico correto da situação clínica e deve conhecer perfeitamente a anatomia vascular o que é fundamental para resultar numa embolização bem sucedida. Em geral a embolização deve resolver a situação clínica num único procedimento, até porque em muitas situações não haverá outras oportunidades. O conhecimento da extensa formação de redes vasculares e o potencial desenvolvimento de colaterais em regiões anatômicas como o abdome ou a pélvis deve formar parte da investigação para se agir apropriadamente. A escolha do agente embólico apropriado deve obedecer a esse conhecimento.
Agentes Embólicos
De forma geral qualquer material que seja biocompatível e biotolerável pode ser utilizado como agente embólico. Ao longo dos anos varias empresas de produtos médicos produziram numerosos tipos de insumos para serem utilizados como agentes embólicos. Desde os pontos de vista didático e prático os “embolizantes” podem ser agrupados de várias maneiras: pelas suas características físicas, pelo tempo de duração da oclusão que provocam, pelo nível de oclusão que provocam (proximal ou distal), pela facilidade do seu manuseio, pelo tipo de condutor que requerem (cateter regular ou microcateter), pelo seu custo e disponibilidade.
Características físicas
Agentes particulados (Gelfoam, PVA, microesferas), Espirais metálicas (de aço inox, de platina, de tungstênio) com ou sem fibras, com controle de destaque ou de destacação livre. Fluidos (álcool, Hystoacril, Ônix, Glubran, outros esclerosantes), Balões destacáveis e cateteres com balão de oclusão (tipo Fogarty). Com exceção dos fluidos esclerosantes, os agentes embólicos agem provocando uma obstrução mecânica e a ativação da agregação das plaquetas e dos mecanismos de coagulação próprios do paciente. Portanto, há que se considerar que as alterações da coagulação bem como a trombocitopenia podem sempre comprometer a eficácia da embolização.
Tempo de oclusão
Existem agentes que provocam uma oclusão temporária (cateter com balão de oclusão), agentes reabsorvíveis que provocam uma oclusão de curta duração (partículas de gelfoam) e agentes que provocam uma oclusão permanente (PVA, coils, balões, fluidos e esclerosantes em geral, etc.).
Nível de oclusão
Isto é um aspecto fundamental da emboloterapia e é um dos fatores que mais influencia a escolha do agente embólico. O objetivo pode ser embolizar ao nível capilar, como acontece em geral com os Tumores, Malformações ou Fístulas AV ou pode se pretender fazer uma embolização de ramos principais como no Trauma de lesões arteriais. Tenha sempre em mente que a utilização de fluidos ou partículas muito pequenas pode provocar duas complicações que sempre devem ser evitadas: a isquemia e necrose de tecidos fora do alvo da embolização e a passagem do agente embólico para o sistema venoso com conseqüente embolização pulmonar.
Tipo de condutor
Os microcateteres são um exemplo da evolução tecnológica que a industria promoveu na área de emboloterapia. Na atualidade, há mais de 40 tipos diferentes de microcateteres. A vantagem obvia dessa ferramenta é que permitem alcançar áreas cada vez mais distantes da anatomia vascular humana. Isto tem sido desenvolvido principalmente na área de neurorradiologia em virtude da extensa rede vascular do sistema nervoso central que condiciona a necessidade de chegar bem próximo da lesão (cateterismo superseletivo) com intuito de se evitar a embolização fora do alvo. Os microcateteres são fundamentais para negociar com tortuosidades acentuadas e irregularidades dos vasos e para lidar com variações anatômicas. Por terem um diâmetro menor, em relação aos cateteres regulares, eles ocupam menos espaço dentro da luz vascular e, portanto, possibilitam um fluxo maior nesta área o que deve ser considerado na escolha do agente embólico. Pode-se dizer que, em geral, os microcateteres provocam menos espasmo em alguns territórios vasculares quando comparados aos cateteres angiográficos regulares. Muitos casos de embolização não poderiam ser realizados sem os microcateteres. Há agentes embólicos para serem utilizados com cateteres regulares e outros específicos para serem usados somente com microcateteres.
Facilidade para manuseio
A utilização de agentes embólicos sempre requer de treinamento. Porem, alguns agentes são de utilização muitos simples, principalmente quando o objetivo é fazer uma embolização não seletiva; é o caso dos cateteres com balão de oclusão, do gelfoam ou alguns tipos de espirais. Há outros agentes que requerem um manuseio mais cuidadoso como, por exemplo, a utilização de histoacryl, ônix, álcool, balões destacáveis e espirais do tipo GDC , hidrocoils ou similares.
Lesões Vasculares básicas
O diagnóstico angiográfico e suas nuances é fundamental para os profissionais que tratam lesões por via endovascular. No caso da emboloterapia, o detalhamento anatômico através da interpretação da imagem angiográfica é o passo inicial para definição da estratégia terapêutica. A relação com a clínica também é necessária para tratar a doença e não simplesmente a imagem. Descreveremos sucintamente as lesões que são tratadas por embolização endovascular ou percutânea, baseadas na relação anátomo-angiográfica.
Sangramento arterial ou venoso: O sangramento é decorrente da ruptura vascular, seja no território arterial ou venoso.
A ruptura vascular pode estar ocasionada por um trauma agudo ou por uma lesão vascular pré-existente.
O resultado é o mesmo: a extravasamento de sangue para fora do leito vascular.
Dependendo do tipo de lesão, o extravasamento de sangue pode ficar contido pelos tecidos adjacentes ou ser vertido para um conduto natural, uma víscera oca, uma cavidade anatômica ou simplesmente através da pele. Desde o ponto de vista angiográfico quando se pesquisa um sangramento em qualquer região anatômica ele ficará caracterizado pelo extravasamento de contraste de forma rápida ou insidiosa. Quando não se acha o extravasamento pode ser achada alguma lesão vascular que possa eventualmente justificar o sangramento: um aneurisma, uma mal formação, um tumor, etc. O tratamento por embolização e sua estratégia dependem fundamentalmente do tipo de lesão e da situação clínica derivante.
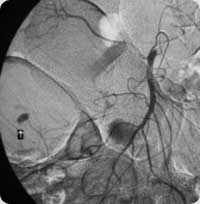
Extravasamento de contraste no intestino grosso direito após injeção na artéria mesentérica superior.
Tumores vascularizados
Certo número de tumores apresenta grande vascularização tumoral. Os tumores que apresentam vascularização tumoral densa e homogênea, com veias de drenagem em tempo circulatório normal são de características benignas; aqueles que apresentam artérias sinusoidais e micro-fístulas intra-tumorais com drenagem venosa de aparecimento mais precoce que o habitual, tem características de malignidades.
A indicação terapêutica é, na maioria das vezes, embolização pré-operatória para reduzir o sangramento e melhorar o plano de clivagem. O conhecimento da anatomia arterial é importante para atingir somente as artérias envolvidas na nutrição da lesão. O embolo deverá atingir a lesão vascularizada e não ocluir o vaso nutridor. Os agentes embolizantes deverão apresentar tamanhos bem pequenos para atingir esse objetivo.
Os materiais mais utilizados são as partículas de tamanhos diferentes. Para a embolização percutânea (por punção) o material utilizado é um fluído: álcool ou histoacryl em forma diluída.
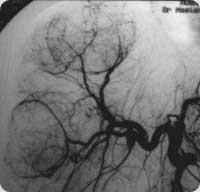
Imagem angiográfica de tumores hepáticos.
Aneurisma sacular
Aneurisma é a dilatação anormal de um vaso que se originam devido a deficiência da camada muscular, mas apresentam o endotélio íntegro. Comumente estão localizados na circulação intracraniana ou nas artérias da circulação visceral: renais, hepáticos, esplênicos e mesentéricos. O tratamento deve ser a oclusão do aneurisma e preservação do vaso portador. O material utilizado são os coils com controles de destacamento ou livres.
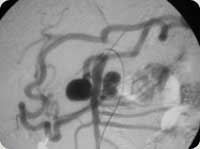
Imagem Angiográfica de aneurismas da ramos mesentáricos.
Falso ou pseudoaneurisma
São os aneurismas que se formam por ruptura da parede arterial por algum tipo de trauma. A absorção do coágulo peri-lesional deixa um espaço sacular com mínima membrana formada pelo tecido conectivo adjacente. Ou seja, os pseudo ou falsos aneurismas não tem parede verdadeira. Para o tratamento ser efetivo toda a lesão deverá ser coberta. O material utilizado é o stent recoberto quando possível, ou então deverá ser realizada a oclusão do pseudoaneurisma e da artéria portadora concomitantemente.
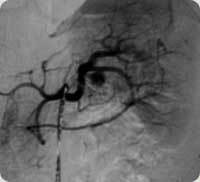
Imagem Angiográfica de um pseudoaneurisma de artéria esplênica.
Fístula artério-venosa
Caracteriza-se por uma comunicação direta entre a artéria e a veia. A maioria delas é de origem traumática. Clinicamente pode-se manifestar pela existência de um frêmito e sopro e às vezes provocam insuficiência cardíaca por sobrecarga. O diagnóstico angiográfico consiste na artéria dilatada e no aparecimento precoce da veia de drenagem, também dilatada. A identificação precisa da comunicação artério-venosa é manifestada pela mudança abrupta do calibre arterial. Este é o ponto a ser tratado. A embolização poderá ser realizada com balões destacáveis ou coils no ponto fistuloso ou, ainda, com a colocação de stents recobertos.
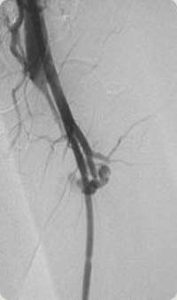
Imagem angiográfica de uma fístula arterio-venosa no território femoral esquerdo.
Malformação artério-venosa
Caracteriza-se por múltiplas artérias dilatadas, com drenagem venosa precoce com a interposição de nidus arteríolo-venular. Clinicamente se apresenta como uma tumefação quente e pulsátil, por sopro sistólico e hiperpulsatibilidade arterial. Raramente estão presentes nas crianças e, na maioria das vezes, aparece em decorrência de trauma local ou alterações hormonais como puberdade, gravidez e aumento de peso.
A angiografia mostra as artérias dilatadas, nidus capilaro-venular bem ou mal definido e veias calibrosas com aparecimento precoce. O tratamento consiste na embolização com partículas pequenas ou substancias adesivas tipo histoacryl, glubran ou onyx, com o microcateter posicionado no nidus, que é o alvo a ser atingido.

Imagem angiográfica de uma MAV intracraniana. Observa-se as artérias nutridoras, o nidus e as veias de drenagem.
Malformações capilares
Pequenos nichos vasculares distais, de pequeno volume, mas múltiplos e disseminados. O mais comum é a telengectasia da doença de Rendu-Osler-Weber. A manifestação principal é a hemorragia e o tratamento é paliativo através de micro partículas. Uma situação que reveste importância é o acometimento de ramos pulmonares na Telangectsia Hemorrágica Hereditária. Nessa situação o tratamento deve ser realizado quando os ramos acometidos são maiores de 3mm. Nesses casos o agente embolizante são as espirais ou balões destacáveis.
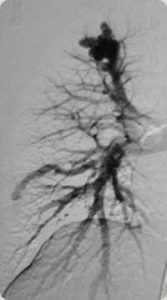
Imagem angiográfica mostrando MAVP no pulmão direito.
Malformações capilaro-venosas
Clinicamente são massas de grande volume que aumentam com as manobras de Valsalva e com as posições de declive, podem exercer efeito de massa e a pele pode apresentar coloração azulada. São acompanhadas quase sempre de flebolitos e pode provocar alterações em volta da lesão como hipertrofia de tecido conectivo ou adiposo e lesões ósseas.
A arteriografia superseletiva com tempo de injeção de contraste prolongado, mostra múltiplas lojas de estagnação do contraste, chamadas de grãos de uva ou lagos venosos. O tratamento por via arterial é infrutífero e o tratamento percutâneo por via venosa é o de escolha, com o uso de álcool absoluto.
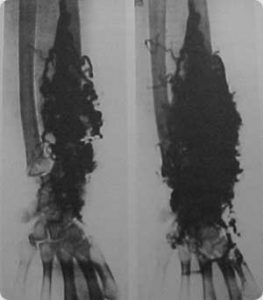
Imagem angiográfica de Maformação capilaro-venosa em membro superior.
Literatura Recomendada
Coldwell DM. Stokes KR. Yakes WF. Embolotherapy: agents, clinical applications, and techniques. Radiographics. 1994;14(3):623-43.
Greenfield AJ. Transcatheter vessel occlusion: selection of methods and materials. Cardiovascular & Interventional Radiology. 1980;3(4):222-8.
Hemingway AP. Allison DJ. Complications of embolization: analysis of 410 procedures. Radiology. 1988; 166(3):669-72.
Pentecost MJ, Teitelbaum, GP eds. Embolotherapy. Semin Intervent Radiol 1992; 9:1-71.
Seppanen SK. Leppanen MJ. Pimenoff G. Seppanen JM. Microcatheter embolization of hemorrhages. Cardiovascular & Interventional Radiology. 1997; 20(3):174-9.
Teitelbaum GP. Reed RA. Larsen D. Lee RK. Pentecost MJ. Finck EJ. Katz MD. Microcatheter embolization of non-neurologic traumatic vascular lesions. Journal of Vascular & Interventional Radiology. 1993; 4(1):149-54.
